Генотерапия
Обновлено: 05.03.2025
Генотерапия - совокупность генноинженерных и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний. Цель этой технологии - исправление дефектов, вызванных мутациями (изменениями) в структуре ДНК, или придания клеткам новых функций.
05.03.25. Генная терапия MeiraGTx восстановила зрение у слепых детей

Американская компания MeiraGTx представила результаты клинического исследования, в котором приняли участие 11 детей с наследственным заболеванием, приводящем к слепоте. Все участники исследования — дети от года до четырех лет — родились с тяжелой формой дистрофии сетчатки, вызванной мутацией в гене AIPL1. До лечения дети могли лишь ограниченно воспринимать свет. В рамках испытаний дети получили генную терапию с помощью инъекции препарата rAAV8.hRKp.AIPL1. Он обеспечивает доставку функциональных копий гена AIPL1 в фоторецепторы сетчатки для восстановления зрения. Вскоре после введения препарата их глаза стали слабовидящим. Дети могли видеть мелкие предметы на столе, перемещать их, например, со стола в стакан. Наблюдения за детьми продолжались в среднем 3,5 года.
2024. Генная терапия восстановила слух у детей, рожденных глухими
Исследователи из специализированной больницы Mass Eye and Ear в Бостоне провели лечение шестерых детей, страдавших формой генетической глухоты под названием DFNB9, которая вызвана мутацией гена, препятствующей передаче звуковых сигналов от уха к мозгу. Они использовали технологию генной терапии, которая включала использование неактивного вируса, несущего функционирующую версию гена, который был введен во внутреннее ухо шести детей. Через 26 недель у пятерых из шести детей восстановился слух, и они даже могли вести "нормальную беседу". До сих пор единственным вариантом лечения таких детей является кохлеарная имплантация. И, конечно, кохлеарный имплантат может оказать им огромную помощь, но у него есть свои ограничения.
2024. В США одобрили терапию на основе CRISPR для бета-талассемии
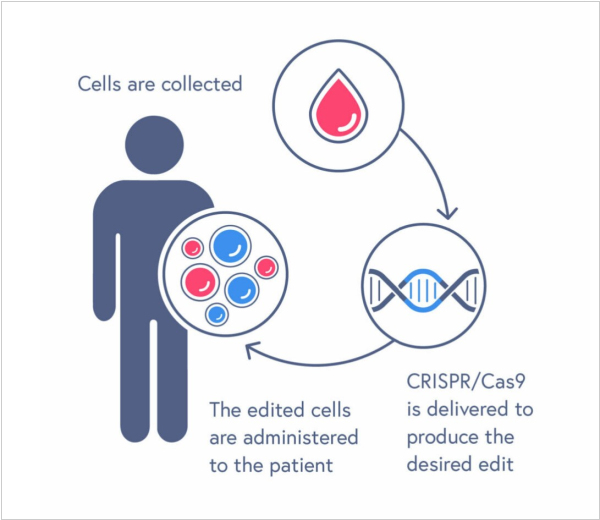
FDA одобрила терапию на основе CRISPR по второму показанию. Им стала бета-талассемия - наследственное генетическое заболевание крови, для которого характерно снижение выработки гемоглобина. Одобрение получил препарат Casgevy компании Vertex Pharmaceuticals. С помощью препарата в кроветворных стволовых клетках, забранных у пациента, выключают ген BCL11A и вводят их обратно в организм. После этого костный мозг начинает вырабатывать фетальный гемоглобин, который замещает собой дефектный. Напомним, впервые CRISPR-терапию одобрили в прошлом году в Великобритании для лечения серповидноклеточной анемии и бета-талассемии.
2023. В Британии одобрили первую в мире CRISPR-терапию для двух заболеваний крови
Управление по контролю лекарственных средств и изделий медицинского назначения в Великобритании разрешило применение первой в мире генной терапии для лечения серповидноклеточной анемии и бета-талассемии для пациентов в возрасте от 12 лет - Casgevy (компании CRISPR Therapeutics). Серповидноклеточная анемии и бета-талассемия - это генетические заболевания, вызванные ошибками в генах гемоглобина. По информации регулятора, Casgevy - первый лицензированный препарат, в котором используется инновационный инструмент редактирования генов CRISPR, за создание которого его изобретатели были удостоены Нобелевской премии в 2020 году. Применение терапии может избавить пациента от необходимости постоянного лечения на долгие годы, потенциально на всю жизнь. В результате тестирования препарата 97% пациентов (28 человек) на год избавились от приступов боли, которая сопровождает заболевание.
2022. Генная терапия впервые помогла исправить врожденный дальтонизм

Появились первые результаты клинических испытаний генной терапии дальтонизма, который проводит Лондонский Институт Офтальмологии UCL (под руководством доктора Тессы Деккер). В исследовании приняли участие 4 ребенка в возрасте от 10 до 15 лет. Каждому была проведена генная терапия на одном глазу, чтобы оценить эффективность лечения. Лечение частично восстановило функцию рецепторов колбочек у двух детей, которые с рождения были полными дальтониками. Терапия была направлена на изменение этих мутацией для восстановления функции рецепторов за счет потенциальной нейропластичности у детей. После лечения, в период от 6 до 14 месяцев, признаки активации колбочек во многом напоминали показатели здоровых детей. По словам ученых, результаты демонстрируют беспрецедентную нейронную пластичность, которая дает надежду на эффективное лечение за счет активации зрительной функции.
2022. Генная терапия замедлила развитие бокового амиотрофического склероза
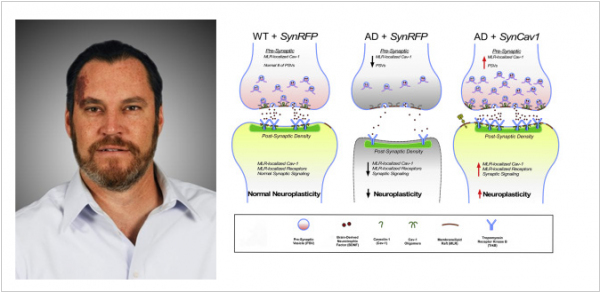
Ученые из Калифорнийского университета в Сан-Диего (под руководством Брайна Хеда) обнаружили, что повышение экспрессии нейропротекторного белка Caveolin-1 улучшает моторную функцию и повышает выживаемость мышей при боковом амиотрофическом склерозе (БАС). В новой работе они использовали аденоассоциированный вирусный вектор, который доставлял кДНК synapsin-Caveolin-1 (AAV-SynCav1) в спинной мозг грызунов. Такой подход защищал моторные нейроны спинного мозга, обычно повреждаемые болезнью, замедлял ее прогрессирование и продлевал жизнь. На фоне лечения у мышей наблюдалось повышение физической силы и подвижности. Примечательно, что ранее генную терапию SynCav1 тестировали на моделях мышей с болезнью Альцгеймера и тогда лечение предотвращало потерю памяти и нарушение способности к обучению также после однократного введения препарата.
2021. В США одобрили первую генную терапию против множественной миеломы
Множественная миелома - редкий тип рака крови, который до сих пор остается неизлечимым и после постановки диагноза наилучшим прогнозом для пациентов является долгая ремиссия. Новый препарат Abecma компании Bristol Myers, попробует изменить эту ситуацию. По результатам 3 фазы его клинических испытаний (в которых приняло участие 127 пациентов с рецидивирующей миеломой), более 70% пациентов ответили на лечение и около трети из них продемонстрировали полное исчезновение всех признаков рака. Abecma представляет собой Т-клеточную иммунотерапию (CAR-T). Процесс лечения основан на заборе и модификации Т-клеток пациента, которые после генетических изменений получают способность нацеливаться и уничтожать миеломные клетки. Однако, Abecma может вызывать серьезные побочные эффекты, поэтому ее назначение и лечение должно проходить под серьезным контролем.
2019. В Калифорнии придумали, как удешевить иммунотерапию рака
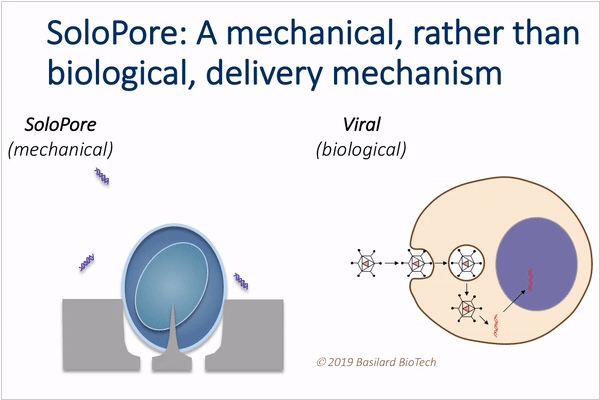
Иммунотерапия рака (в частности CAR-T) остается очень дорогой процедурой, в частности, из-за дороговизны процесса выращивания (в лаборатории) генно-модифицированных иммунных клеток из собственных клеток пациента. Особенно не дешево создание вирусов-носителей, которые доставляют новые гены в клетки (рисунок справа). Ученые из Университета Калифорнии придумали прибор, который позволит значительно удешевить этот процесс. Вместо биологических вирусов он использует нано-иглы, прокалывающие оболочку клеток (рисунок справа). Через образовавшееся отверстие отрезки ДНК проникают в клетки. Управляя потоком раствора с клетками, протекающим по поверхности с нано-иглами, прибор обеспечивает минимально-инвазивные проколы, которые не вредят жизнеспособности клеток.
2019. Verve Therapeutics хочет избавить людей от болезней сердца при помощи CRISPR
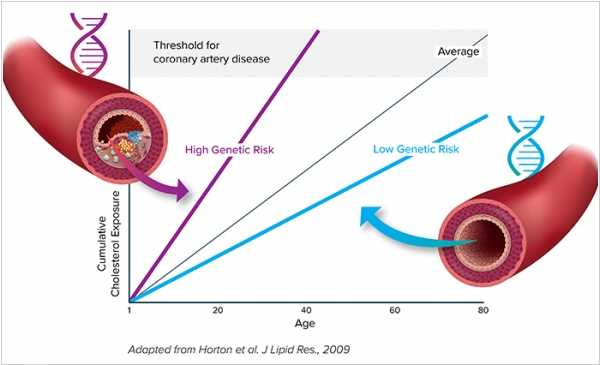
Как известно, одной из основных причин сердечной недостаточности, является наличие в крови «плохого» холестерина, оседающего на стенках сосудов. Причем, у одних людей проблем с этим плохим холестерином - вообще нет, а другим приходится принимать статины, придерживаться диеты и активно заниматься спортом. Причина - в различии определенных генов. Стартап Verve Therapeutics - нашел эти гены и придумал, как их редактировать прямо в организме при помощи CRISPR. Если Verve добьется своего, для снижения риска сердечно-сосудистых заболеваний будет достаточно одной инъекции наночастиц с нужными генами и комплексом CRISPR. В компании не разглашают список участков ДНК, которые предполагается редактировать, однако, скорее всего, это гены, работающие в печени. Verve Therapeutics уже привлек $58,5 млн инвестиций, в том числе от Google.
2019. Генотерапевтический препарат Ziopharm дает надежду на лечение глиобластомы
Лечение глиобластомы (рака мозга) остается одной из самых сложных задач, но радует то, что разработчики постоянно находят и пробуют новые методы. Одной из многообещающих технологий было использование вещества IL-12, которое направляет иммунные клетки на атаку опухоли. Однако, это вещество может работать слишком хорошо, и иммунные клетки создают токсичные воспаления. Американская компания Ziopharm Oncology нашла способ регулировать воздействие вещества IL-12 генотерапевтическим оральным препаратом veledimex. Хотя на 1 фазе клинических испытаний целью была проверка безопасности препарата, он уже показал заметную эффективность в лечении глиобластомы.
2019. Генотерапевтический препарат против ожирения Setmelanotide прошел клинические испытания

Американская компания Rhythm Pharmaceuticals сообщила, что ее препарат от генетических форм ожирения Setmelanotide успешно прошел 3 фазу клинических испытаний. Планируется, что он появится в продаже в следующем году. Препарат блокирует рецепторы нейронов мозга, которые реагируют на гормоны аппетита и запускают пищевое поведение. Конечно, нельзя сказать, что препарат - особо эффективный. В клинических испытаниях он снижал вес пациентов в среднем на 10%. Но нужно принимать во внимание, что бороться с генетическим ожирением - гораздо сложнее, чем с ожирением из-за переедания.
2019. Sangamo и Pfizer показали эффектиность генотерапии от гемофилии А
В прошлом году американский стартап Spark Therapeutics объявил об успешных клинических испытаниях генотерапевтического препарата от Гемофилии Б. А теперь, другой стартап Sangamo (совместно с фармагигантом Pfizer) обнародовали данные о долговременной эффективности подобной генотерапии для лечения более распространенной Гемофилии А. Препарат SB-525 доставляет необходимый ген в клетки печени пациента и они начинают производить протеин, необходимый для свертывания крови (напомним, Гемофилия - это врожденное нарушение свертывания крови, в результате чего ребенок страдает от внутренних кровотечений в суставах).
2018. Разработана система доставки ДНК-редактора для генотерапии почек
Диабет, гипертония и другие состояния вызывают хроническое заболевание почек, при котором поврежденные почки не могут эффективно выводить отходы и избыток жидкости из организма. А лечить хроническую болезнь почек пока не научились. На терминальной стадии болезни применяется диализ и пересадка почки. Есть надежда на генотерапию, которая могла бы починить ДНК клеток почек, но до сих пор не было способа доставить вирус с генетическим материалом точно в почки. Специалисть Школы медицины Университета Вашингтона в Сент-Луисе такой способ изобрели и успешно испытали его на мышах. Синтетический вирус Anc80, созданный ими, оказался успешным в достижении двух типов клеток, которые участвуют в развитии хронического заболевания почек: эти клетки секретируют белки, которые наносят необратимый ущерб органу. Правда, пока еще ученые не знают, какой именно ген нужно исправлять в поврежденных клетках почек.
2017. CRISPR использовали против болезни Хокинга
Боковой амиотрофический склероз (БАС), которым, в частности, болеет Стивен Хокинг - это медленная, но неизлечимая деградация нейронов, которую связывают с мутациями в определенных генах. Дэвид Шаффер и его коллеги из Калифорнийского университета в Беркли придумали использовать технологию редактирования ДНК CRISPR/Cas9 для замены гена SOD1, который у людей ответственен примерно за 20% случаев БАС. Авторы провели эксперименты на мышах, несших мутантный человеческий ген. Для доставки CRISPR/Cas9 в спинной мозг ученые использовали специальным образом модифицированные аденовирусы, которые практически безопасны для людей. У мышей, прошедших такую экспериментальную терапию, признаки болезни развивались заметно медленнее, и в среднем они жили на месяц дольше – не так мало для положенного этой ГМ-линии 4-месячного срока. Посмертное исследование тканей показало, что в спинном мозге таких животных выжили лишь те двигательные нейроны, в которых произошла успешная замена гена.
2017. FDA разрешило использовать генную терапию Luxturna для лечения врожденной слепоты
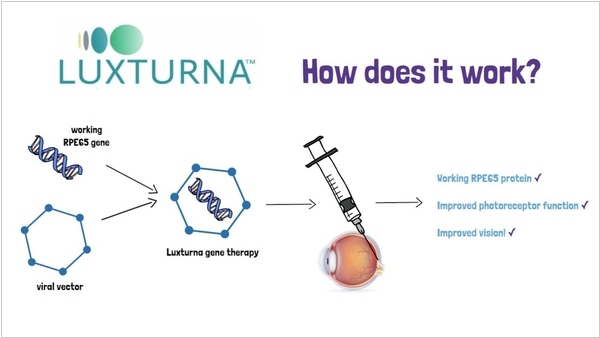
Подразделение Spark Therapeutics компании Roche получил сертификацию FDA на препарат Luxturna для излечения врожденной частичной или полной потери зрения, которая вызвана мутацией в гене RPE65. Активный компонент препарата содержит ДНК с нормальным геном RPE65, который вводится в организм человека напрямую, где и заменяет затем мутировавший ген. Препарат вводится прямо в глазное яблоко, после чего клетки сетчатки с активным геном начинают вырабатывать названный фермент, в результате чего зрение улучшается. Однако, препарат можно использовать лишь в том случае, если у пациента сохранились активные клетки сетчатки глаза.
2017. В США одобрили вторую генную терапию для лечения рака крови

Американский регулятор FDA одобрил вторую генную терапию для борьбы с раком крови: препарат Yescarta (компании Kite Pharma). Он предназначен для лечения агрессивной лимфомы у взрослых. Первым одобренным антираковым генотерапевтическим препаратом стал Kymriah (компании Novartis). В Yescarta применяется та же технология (CAR-T), что и в первой генной терапии. Она редактирует иммунные Т-клетки так что они начинают атаковать раковые клетки. Стоит Yescarta немного дешевле - 373 тыс. долларов для одного пациента. Причем есть потенциал к снижению этой стоимости, т.к. в США - более 7 тысяч пациентов в год, которым подходит эта технология. А чем больше пациентом покупают препарат, тем дешевле он становится.
2017. Антираковая генотерапия CAR-T сертифицирована в США
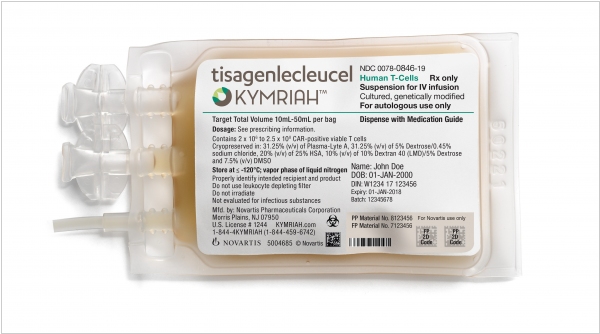
Технология CAR-T и препарат Kymriah (Кимрия) швейцарской компании Novartis, которая уже доказала свою эффективность в лечении острого лимфобластного лейкоза, была сертифицирована американским регулятором FDA (что еще раз подтверждает ее действенность). Суть технологии в том, что врачи берут образец белых кровяных телец пациента, а потом в лаборатории перепрограммируют их в убийц опухолей. Затем клетки возвращают в тело, где они быстро группируются и уничтожают раковые клетки. Конечно, стоимость такого лечения - не всем по карману - $475,000. Правда, Novartis обещает вернуть деньги, если организм пациента не отвечает на лечение.
2017. Самое дорогое лекарство в мире провалилось
Glybera, самое дорогое лекарство в мире, а также первое эффективное средство генной терапии в западном мире - оказалось коммерчески убыточным. Оно призвано излечивать от дефицита липопротеинлипазы — редкого наследственного заболевания, из-за которого кровеносные сосуды закупориваются жиром, что приводит к летальному исходу. Голландская компания uniQure, которая производила лекарство объявила о нежелании продлевать лицензию на продажу препарата, срок которой истекает осенью 2017 года. Дело в том, что стоимость полного курса лечения лекарством Glybera составляет около 1,5 млн евро, поэтому с 2012 года всего один пациент прошел курс лечения этим препаратом (но кстати, успешно).
2017. Аппарат Prodigy сделает иммунотерапию рака менее элитарной

Как известно, швейцарская компания Novartis уже успешно лечит (ранее неизлечимые) формы рака с помощью технологии генотерапии CAR-T. Однако, эта услуга доступна только в нескольких медицинских центрах за большие деньги. Дело в том, что в каждом случае забранные у пациента иммунные клетки замораживаются и переправляются на фабрику в Нью Джерси, где они исследуются и редактируются высококвалифицированными специалистами в специальных чистых комнатах, а потом отправляются обратно. Сложность и длительность процесса в каждом случае - непредсказуема. Но немецкая компания Miltenyi может помочь автоматизировать этот процесс прямо в медицинском центре. Она создала (и уже тестирует) аппарат Prodigy, который умеет редактировать ДНК иммунных клеток в крови пациента. Аппарат стоит $150 тыс, а комплект расходных материалов на 1 пациента - $12 тыс.
2017. Exonics Therapeutics хочет вылечить мышечную дистрофию с помощью CRISPR

Мышечная дистрофия Дюшенна - это генетическое заболевание мышц у детей, приводящее к распаду мышечной ткани. Американский стартап Exonics Therapeutics получил $5 млн на создание технологии лечения этого заболевания с помощью генной терапии CRISPR. Технология была разработана в Университете Техаса ученым Эриком Олсоном, которому удалось вылечить мышь от мышечной дистрофии в прошлом году. На следующем этапе разработчики собираются вылечить обезьяну, а потом дело дойдет и до клинических испытаний на людях. Лидерами в разработке CRISPR-технологий являются стартапы Editas Medicine, Intellia Therapeutics и CRISPR Therapeutics. Но они фокусируются в основном на заболеваниях глаз, крови, печени и раке.
2017. Перепрограммирование клеток способно омолодить организм
Теоретически, чтобы омолодить орган нужно почистить его от старых клеток и доставить в него новые (стволовые) клетки, способные к дифференцированию и делению. А что если перепрограммировать старые клетки, чтобы они стали стволовыми? Ведь японцы научились делать это еще 10 лет назад (правда, в лаборатории). Остается попробовать проводить подобный фокус в живом организме. Именно такой подход предприняли ученые из Института Солка в Калифорнии. С помощью вирусов-носителей они доставляют в организм мыши трансгены и редактируют ДНК клеток, преобразуя их в стволовые прямо в органах и тканях. Говорят, что таким образом удается продлить жизнь мышки на 30%. Правда, говорят, нужно проводить процесс омоложения потихоньку - короткими циклами. Ибо, перевод большого числа функциональных ***
2017. Суд разрешил патентный спор о правах на CRISPR/Cas9

Технология редактирования ДНК CRISPR/Cas9 считается одним из главных инструментов медицины будущего. Но не менее интересная история происходит за кулисами. Технология была изобретена в 2012 году профессором института Бэркли - Дженифер Даудна совместно с Эммануэль Шарпетье из немецкого института Планка. В 2013 другой исследователь Фен Жанг из института Броуда (связанного с MIT) придумал как использовать эту технологию на живых клетках. Кроме того, он успел быстрее Дженифер получить патент на технологию, хотя подал патент на 8 месяцев позже нее. После этого изобретатели рассорились. Каждый со-основал свой стартап, нацеленный на создание конкретных терапий на базе CRISPR/Cas9: Дженифер - Intellia Therapeutics, Эммануэль - CRISPR Therapeutics, а Фен Жанг - Editas Medicine. ***
2017. Разработаны наночастицы для безопасной доставки CRISPR/Cas9 в клетки
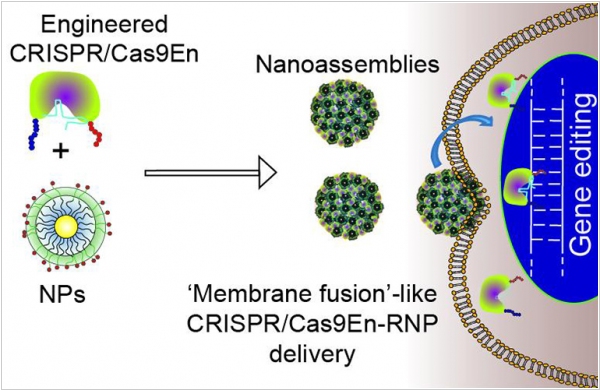
Система редактирования ДНК CRISPR/Cas9 состоит из протеина (который собственно редактирует) и сигнальной РНК (которая помещает его на нужную позицию). Эти штучки работают нормально, но процент успешно-отредактированных клеток все еще остается довольно низким. Причина в том, что доставить протеин и РНК через мембрану клетки в ядро так чтоб они не повредились - довольно сложно. Исследователи из Массачусетского университета Амхерст разработали наночастицы, которые служат в качестве контейнера для CRISPR/Cas9. Они пробивают клеточную мембрану и выпускают груз в цитоплазму клетки. С помощью такой доставки процент успешных редактирований удалось повысить до 30%, что по словам разработчиков - великолепно. Причем, пока они используют технологию только на культивированных в лаборатории клетках, а не в живых организмах.
2016. Создана технология редактирования ДНК в неделящихся клетках
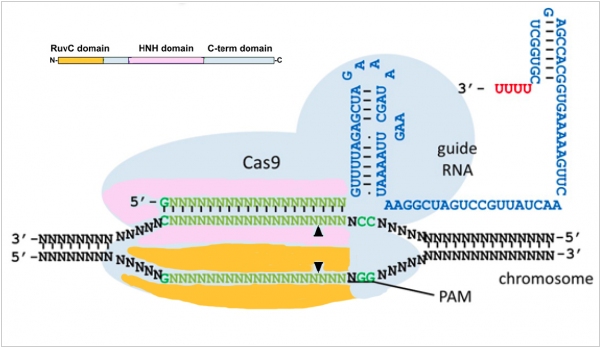
Революционная технология редактирования ДНК CRISPR/Cas9 может с высокой точностью вырезать нужный фрагмент ДНК. Но восстановление разрезанной нити ДНК и вставка в разрез нового сегмента хорошо проходит только в делящихся клетках. Однако во взрослом организме большинство клеток уже сформировалось и делится редко. Если нужно отредактировать мутацию именно в них (например, вылечить взрослого человека от слепоты или от нейродегенеративного заболевания), возникают трудности. Группа генетиков из Института Солка в Калифорнии разработала технологию HITI для сшивания ДНК во взрослых клетках. Первым применением технологии CRISPR/Cas9 + HITI, стало возвращение зрения грызунам c пигментным ретинитом - генетическим заболеванием, при котором происходит деградация фоторецепторов сетчатки. В дальнейшем эту технологию можно применять для лечения широкого спектра генетических заболеваний органов зрения, нервной и сердечно-сосудистой систем.
2016. Китайцы первыми применили технологию CRISPR-Cas9 для лечения человека

Пока американские компании спорят на счет того, кому принадлежать права на революционную технологию редактирования ДНК CRISPR-Cas9 и планируют ее первые клинические испытания, китайцы (из Сычуанского университета) уже умудрились применить эту технологию в реальном кейсе. Они использовали технологию для модификации клеток иммунной системы, взятых у пациента, а затем (когда клетки размножились) ввели их обратно в организм, чтобы те более эффективно боролись с раковыми клетками (рак легких). Напомним, недавно подобную технологию успешно применила и в Великобритании конкурирующая фирма - Cellectis. Но они используют не CRISPR-Cas9, а CAR-T.
2016. Стартап останавливает болезнь Паркинсона с помощью генотерапии

Пациенты с болезнью Паркинсона, начинающие принимать лекарство Леводопа, сначала испытывают головокружение от успехов - болезнь резко отступает. Но постепенно препарат становится все менее эффективным. Дело в том, что при болезни Паркинсона мозг постепенно теряет способность производить не только допамин (который и восполняет Леводопа), но и фермент AADC (из которого Леводопа и производит допамин). Американский стартап Voyager Therapeutics разработал технологию генотерапии, которая позволяет отредактировать ДНК в нейронах мозга таким образом, чтобы они производили этот фермент. В результате, Леводопа продолжает эффективно справляться с симптомами болезни. Правда, для ввода редактирующего ДНК вируса в мозг необходимо проведение хирургической операции.
2016. Открылся первый в России центр по созданию лекарств генотерапии
Биотехнологическая компания BIOCAD, лидер по научной разработке инновационных лекарственных средств в России, открыла первый в стране научный комплекс по созданию лекарственных препаратов передовой терапии, так называемых ЛППТ. Это новое направление в современной медицине – препараты генной и клеточной терапии, которые способны вылечить заболевания, ранее не поддававшиеся лечению. Сегодня в мире всего 13 лекарств подобного класса. "Цель создания лабораторий – обеспечение возможности развития в нашей стране медицины будущего, – комментирует генеральный директор BIOCAD Дмитрий Морозов. – Медицина будущего нацелена не просто на лечение болезни, ее симптомов, а на превентивную защиту организма, исправление первичных дефектов на уровне гена".
2016. Технологию редактирования генома CRISPR/CAS-9 испытают для лечения рака

До сих пор предполагалось, что революционная технология редактирования генома CRISPR/CAS-9 будет впервые испытана на людях в 2017 году (для лечения редкой болезни сетчатки). Однако, вице-президент США Джо Байден (который недавно был назначен главным по борьбе с раком), протолкнул идею более скорого проведения испытания этой технологии для лечения рака (а именно - меланомы, миеломы и саркомы). Финансировать тестирование вызвался тот самый Шон Паркер. Для старта клинических испытаний, которые пройдут в онкологическом центре им. Андерсона (в Техасе), осталось лишь получить разрешение FDA. Во время испытаний у пациентов возьмут имунные Т-клетки, модифицируют их с помощью CRISPR и введут обратно в организм, чтобы они уничтожили опухоль. Напомним, недавно подобную технологию успешно применила в Великобритании конкурирующая фирма - Cellectis.
2016. Биоинженеры MIT хотят превратить медицину в программирование
Генотерапия - одна из наиболее перспективных медицинских технологий. Она позволяет перерограммировать определенные клетки прямо в живом организме с помощью редактирования их ДНК. Разработчики Массачусетского технологического института (MIT) уже дошли до того, что создали язык программирования, подобный обычному языку программирования для компьютера, и компилятор, который превращает программу в последовательность ДНК, которая будут встраиваться в ДНК клеток организма. При этом, программист может даже ничего не знать о том, как работает генная терапия, а просто решать поставленную медиками задачу, используя текстовый язык. Исследователи планируют создать доступный в Интернете интерфейс, а также библиотеку готовых модулей (а-ля фреймворк).
2016. Технология Cellectis вылечила уже второго ребенка от лейкемии

Франко-американская компания Cellectis, похоже, заняла лидирующую позицию на многообещающем рынке иммунотерапии рака. В конце прошлого года ее технология TALEN (основанная на методе CAR-T) помогла вылечить годовалую девочку от лейкемии, а недавно они объявили о второй успешной операции, проведенной в том же лондонском госпитале. Смысл технологии в том, что ДНК иммунных клеток (Т-лимфоцитов) модифицируется в пробирке, а затем они вводятся в организм, где уничтожают поврежденные при лейкемии кровяные клетки. Есть еще три перспективных стартапа, разрабатывающих подобные технологии (Novartis, Juno Therapeutics и Kite Pharma). Но отличие технологии Cellectis в том, что она использует донорские Т-клетки, т.е. потенциально может создать универсальный и дешевый препарат, который можно быстро ввести любому пациенту.
2016. Новая технология удаляет гены ВИЧ из клеток в живом организме

Исследователи из Темпльского университета (США) под руководством Камела Халили (на фото) впервые успешно вырезали сегмент ДНК, принадлежавший вирусу ВИЧ, из всех клеток в живом организме (мыши) с помощью технологии редактирования генов CRISPR/Cas9. В организмы животных вводили аденовирусный вектор — молекулу, которая содержала в себе необходимые нуклеотидные последовательности, а также гены белка Cas. Через две недели после начала эксперимента оказалось, что сегмент ВИЧ был вырезан из ДНК во всех тканях, в том числе в головном мозге, почках, печени, лёгких, селезёнке и клетках крови. Анализ вирусной РНК показал, что её количество сильно снизилось в клетках лимфоцитов, а также в лимфатических узлах.
2016. Генотерапия поможет в борьбе с раком мозга

Ученые из Международной школы продвинутых исследований (SISSA) в Триесте, Италия, разработали метод генной терапии, который оказался эффективным в борьбе с одним из видов агрессивного рака мозга – глиобластомой. В технологии используется ген Emx2, активация которого успешно предотвращает рост раковых клеток. В ходе эксперимента на мышах ученые смогли найти участок ДНК, который активирует Emx2 только в злокачественных клетках. В результате ген успешно справился с четырьмя разновидностями глиобластомы. По словам ученых, метод генной терапии, который позволяет выборочно атаковать опухоль, может дать надежду на исцеление от этого смертоносного вида рака мозга, при котором хирургическое вмешательство практически невозможно, а лучевая и химиотерапия неэффективны.
2016. Генная терапия останавливает дистрофию мускулов

Сразу три группы американских генетиков заявили о том, что им удалось использовать универсальный генетический редактор CRISPR/Cas9 для того, чтобы вылечить дистрофию мышц (пока у мыши). Дистрофия мышц - это врожденное генетическое заболевание, вызванное повреждением в гене, отвечающей за синтез белка дистрофина. При помощи Фен Чжана (изобретателя CRISPR/Cas9), генетики научились редактировать эти гены. Для доставки препарата был использован модифицированный аденовирус, «боевая часть» которого была заменена на систему CRISPR/Cas и «негативы» заменяемых ей генов. Вирус был введен в кровоток животного. В результате, мускулы начали производить дистрофин и укрепляться, причем это происходило не только в пораженных ногах, но и в сердце и в других частях тела мышей.
2015. Элизабет Пэрриш - первая пациентка, лечащая старость генотерапией

Элизабет Пэрриш - основательница американского стартапа BioViva, который ставит своей целью продление жизни человека. На днях она наделала шуму в интернете, объявив, что сама лично прошла процедуру генотерапии для лечения старения (сейчас ей 44 года). Для этого ей пришлось ехать в Колумбию, т.к. в США подобные эксперименты запрещены без разрешения FDA. Технология, которую испытала на себе Элизабет, предполагает введение в кровь вирусов, содержащих генетический материал, производящий теломеразы (белок, который удлиняет теломеры). Теломеры - это компоненты хромосом, которые (по мнению некоторых ученых) определяют максимальное число делений клетки, что в конечном итоге, ограничивает жизнь организма. Ранее подобная технология тестировалась на мышах, и в результате, удалось продлить их жизнь на 20%. Конечно, с большой долей вероятности, Элизабет просто пытается привлечь внимание и инвестиции для своего стартапа, однако, в любом случае, ее цель - вызывает уважение.
2015. Технологию генотерапии CRISPR начнут применять на людях в 2017 году

Катрин Босли, руководитель американской компании Editas (разработавшей знаменитую технологию редактирования ДНК CRISPR-Cas9), заявила, что клинические испытания технологии на людях начнутся в 2017. Для начала компания выбрала редкую болезнь сетчатки Амавроз Лебера, вызывающую врожденную слепоту. Этой болезнью страдают всего лишь 600 человек в США, но именно благодаря этому у Editas будет больше шансов получить сертификацию FDA. Кроме того, сетчатка глаза - одно из наиболее удобных мест для использования генотерапии, т.к. нет проблем с доставкой лекарства (медики умеют делать инъекции прямо в сетчатку). Потенциально же, CRISPR может использоваться для лечения любых генетических болезней. Эта технология позволяет с высокой точностью заменить нужный отрезок ДНК прямо в клетках живого организма.
2015. Генная терапия дает надежду в лечении болезни Альцгеймера
Команда исследователей Калифорнийского университета Сан-Диего опубликовали результаты своих (10-летних) клинических испытаний технологии лечения болезни Альцгеймера, основанной на генной терапии. Технология предполагает доставку в нейроны мозга гена фактора роста нервов (NGF). Этот ген производит белок, поддерживающий жизнеспособность нейронов, стимулирующий их развитие и активность. Ген доставляли с помощью модифицированного вируса, а также в составе клеток соединительной ткани - фибропластов, созданных из клеток кожи участников. По заверению ученых, методика показал свою безопасность, и у всех без исключения пациентов был заметный положительный эффект от процедуры – в областях введения NGF наблюдался обширный рост нервных клеток, чего не было заметно в незатронутых медиками отделах мозга. В настоящий момент запущена II фаза испытаний – она покажет, насколько эффективно генная терапия может бороться с болезнью Альцгеймера, а также другими нейродегенеративными нарушениями.
2015. Новая технология позволяет доставлять в легкие лекарства для генотерапии
Некоторые серьезные болезни легких (такие как ХОБЛ, муковисцидоз) потенциально можно было бы излечивать при помощи генной терапии. Однако есть проблема с доставкой ДНК-вирусов, которыми можно редактировать гены клеток в легких - защитный слой слизи, который служит для защиты эпителиальных клеток лёгких. Однако, команда ученых Университета Джона Хопкинса разработала технологию доставки генотерапевтических препаратов в легкие при помощи наночастиц. Ввод препарата осуществляется с помощью обычной ингаляции. При этом грузовые наночастицы, преодолев барьер и выпустив лекарство, постепенно разлагаются и самостоятельно удаляются из легких .
2015. Видео: как происходит редактирование ДНК методом CRISPR
Открытие технологии CRISPR (в 2013 году) называют лучшим, что случилось в медицине за последние несколько лет. Эта технология позволяет редактировать ДНК отдельных клеток, а теоретически и всех нужных клеток в живом организме. В будущем это позволит целиком удалять из генома взрослого человека дефектные гены - например, вызывающие рак или диабет. Или можно будет отредактировать клетку эмбриона для рождения максимально здорового ребенка нужного пола. Данное захватывающее видео показывает, как именно работает технология CRISPR. Если коротко, CRISPR использует естественную реакцию (иммунитет) клетки на появление чужеродного вируса. Чтобы научиться бороться с вирусом (запомнить его), клетка вырезает часть его ДНК и вставляет в свою ДНК. Таким образом, создавая и запуская в клетку правильный вирус, можно перепрограммировать ее геном.
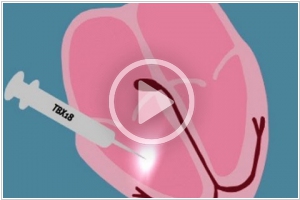
2014. Генетическая модификация сердца вместо кардиостимулятора
Кардиостимуляторы являются самой успешной медицинской технологией в расчете по числу сохраненных жизней. И эта технология постоянно развивается. Так, уже начали устанавливать кардиостимуляторы размером с таблетку прямо в сердце. Однако, возможно скоро миллиардный рынок электронных кардиостимуляторов будет подорван. Ученые из Кардиологического института Сидерс-Синай (Лос-Анджелес) смогли с помощью генотерапии создать биологический кардиостимулятор. Они ввели в сердечную мышцу (свиньи) ген TBX-18, который отвечает за регулярность сокращений, и сформировали участок, вызывающий сокращения сердца. Потенциально этот метод более безопасен, чем традиционный кардиостимулятор, т.к. практически исключается возможность отторжения и занесения инфекции.
2014. Ученые разработали генотерапевтическую вакцину от инфаркта
Причиной инфаркта в большинстве случаев является высокое содержание холестерина в крови, что приводит к атеросклерозу сосудов. Ученые из Гарвардского института стволовых клеток заявили, что ими разработана вакцина, способная ***
2014. Кохлеарный имплантант восстанавливает слуховой нерв при помощи генотерапии
Помните видео о том, как глухой человек слышит при помощи кохлеарного имплантанта? Если помните, слышимость не очень хорошая. Но это проблема не только технологии самого имплантанта. Дело в том, что у многих пациентов в следствии длительной потери слуха концы слуховых нервов атрофируются и даже после установки кохлеарного имплантанта - они слабо проводят звуковой сигнал к мозгу. Ученые из университета Нового Южного Уэльса в Сиднее придумали способ, как восстанавливать эти нервные окончания при помощи самого кохлеарного имплантанта. Их метод основан на генотерапии - внедрении в ДНК клеток слухового нерва гена, который стимулирует рост клеток. Причем, доставляется этот ген не с помощью вируса (как обычно), а с помощью электрических импульсов, создаваемых кохлеарным имплантантом. Для этого в улитку уха (морской свинки) заправили генетический материал, который проник в клетки нерва через поры, созданные электрическими импульсами.
2014. Sangamo пробует лечить СПИД с помощью генотерапии

Вирус иммунодефицита (ВИЧ) уничтожает человеческие имунные Т-клетки, атакуя их белок, кодируемый геном CCR5, что и приводит к возникновению заболевания под названием СПИД. Американская биотехнологическая компания Sangamo использовала свою технологию молекулярных ножниц (ZFN-технологию), чтобы разрезать ДНК Т-клеток в определенных местах и отключить этот ген CCR5. В результате человеческие иммунные клетки становятся неуязвимыми к ВИЧ и распространение заболевания как минимум останавливается. А если учесть, что в организме постоянно появляются новые Т-клетки, а старые умирают, то потенциально с помощью генотерапии можно полностью излечить больного. Ученые не ограничились экспериментами в пробирке, а уже провели клиническое испытание на 12 пациентах. По окончании исследования у всех участников наблюдался повышенный уровень Т-клеток, а у одного из участников вирус не распространялся в организме в течение 12 недель после отмены антиретровирусной терапии.
2014. Генотерапия против дегенеративной болезни сетчатки
Два года назад американские исследователи добились прогресса в лечении редкого заболевания сетчатки (амаврозомы Лебера) с помощью генетической терапии. На этот раз уже британские ученые из Оксфордского университета провели испытания генотерапевтического метода лечения более распространенного заболевания - хороидеремии - наследственной дегенеративной болезни сетчатки. Пять месяцев назад шести пациентам с такой болезнью была проведена хирургическая операция - под слой сетчатки был введен препарат с вирусом, который доставляет недостающий ген в Х-хромосому клеток сетчатки. Практически у всех пациентов сейчас наблюдается улучшение зрения или по крайней мере - отсутствие дальнейшей его потери. Но исследователи говорят, что чтобы сделать окончательные выводы - нужно еще 2 года. Кроме того, они заявляют, что данный метод лечения можно применять только до определенной точки в течении болезни. Если заболевание уже перешагнуло через эту точку - обратно зрение уже не вернуть.
2013. Американские стартапы разрабатывают технологии генной терапии

Если журнал Science назвал главным прорывом 2013 года в научной медицине иммунотерапию рака, то другой (не менее авторитетный журнал) Nature особо отметил технологию редактирования генома в живых клетках при помощи системы CRISPR, разработанную американским стартапом Editas Medicine. Конечно, генотерапия - круче иммунотерапии, потому что иммунотерапия борется с самим заболеванием, а генотерапия - с его источником - с ошибкой в ДНК. Так вот, новая технология CRISPR якобы позволяет намного дешевле и точнее доставлять редактор ДНК в нужные клетки и надежнее обрезать лишние (вредные) отрезки ДНК, чем существующая технология, использующая вирусы. В первую очередь Editas Medicine планирует использоваться свое генетическое лекарство для лечения нейропсихиатрических расстройств, таких как болезнь Хантингтона и шизофрения. Стартап привлек уже $43 млн инвестиций - а такие деньги на ветер не бросают. ***
2013. Оптогенетическая терапия GenSight обещает излечение слепоты

Французская компания GenSight Biologics разработала технологию ***
2012. В Европе выпущено первое коммерческое лекарство для генотерапии
Только в прошлом месяце мы рассказывали о том, что первое генотерапевтическое лекарство было сертифицировано в России, а сегодня подобный прорыв произошел и в Европе. Европейская комиссия одобрила лекарство Glybera, которое производится голландской компанией uniQure и предназначено для лечения липопротеинолипазной недостаточности. Это довольно тяжелая генетическая болезнь, вызывающая смертельно опасный панкреатит. Кроме того, это довольно редкая болезнь, поэтому Glybera будет стоить очень дорого. Фактически, это будет самое дорогое лекарство в истории медицины. Курс лечения обойдется пациенту в 1,6 миллиона долларов. Но глава uniQure Йорн Альдаг не считает, что это дорого, т.к. "это лекарство не лечит, а навсегда исцеляет человека" (вот так уверенно говорит он). ***
2012. В России сертифицировали первое в мире лекарство для генотерапии

Многие (или все?) болезни вызваны несовершенством генов человека. Поэтому генная терапия (лечение, направленное на корректировку генома) - это, пожалуй, наиболее важная отрасль Медицины 2.0. Однако, как нетрудно догадаться, изменить гены (ДНК) в множестве клеток - это вам не зуб запломбировать. Это очень сложно. И насколько нам известно, сертифицированных генотерапевтических лекарств и технологий в мире еще нет. Т.е. не было до сегодняшнего дня. Сегодня российский Институт Стволовых Клеток Человека получил гос. регистрацию на свой новый препарат Неоваскулген, использующий генную терапию для лечения хронической ишемии (нарушения кровоснабжения) нижних конечностей. ***
2012. Генная терапия помогает восстановить зрение
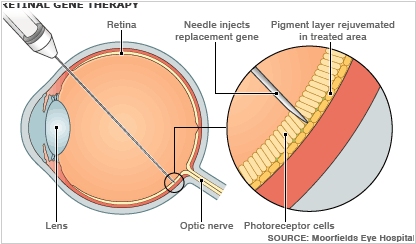
Группа ученых Университета Пенсильвании сообщила об успешных результатах генной терапии редкого заболевания сетчатки (амаврозомы Лебера), которое приводит к слепоте. Несколько лет назад 12 пациентам, которые абсолютно ничего не видели, в один глаз был введен вирус с геном RPE65 (именно его дефект и лежит в основе заболевания). В 2008 году были подведены результаты 1 этапа: терапия улучшила некоторым образом зрение пациентов без возникновения каких-либо существенных побочных эффектов. Далее трем из участников испытания ввели препарат в другой глаз. И вот недано были опубликованы результаты: лечение способствовало дальнейшему улучшению зрительных способностей, пациенты уже могли видеть в сумерках, распознавать лица людей и совершать самостоятельно покупки в магазине. Теперь ученые собираются применить данный метод для второго глаза у оставшихся девяти пациентов.